
TECHNIQUES IMMUNOLOGIQUES





I – 2 – Dualités structurale et fonctionnelle :
I - 3 - Classes et sous classes des immunoglobulines :
I – 4 - 1 – Aspects cytologiques :
I - 4 – 2 – Aspects biochimiques :
I - 4 - 3 - Aspects génétiques :
I – 5 – Spécificités antigéniques des immunoglobulines
I – 6 – Superfamille des immunoglobulines :
I – 7 - Dynamique de la réponse immunitaire à médiation humorale :
I - 7 – 1 - Les mécanismes de la production des immunoglobulines
I - 7 – 2 - La réponse humorale :
Les
anticorps sont des glycoprotéines présentes dans le plasma, les liquides interstitiels
et les sécrétions des mammifères. Ces immunoglobulines
« circulantes » sont en tous points identiques à l’immunoglobuline de
surface du LcB, à l’exception d’une portion membranaire présente sur l’Ig
ancrée sur le Lc et qui disparaît dans l’anticorps correspondant sécrété par le
plasmocyte.
Les immunoglobulines sont des glycoprotéines douées d'activité anticorps, produites par les LcB et excrétées par leur descendance plasmocytaire.
Elles possèdent deux extrémités variables
identiques et propres à chaque Ig, et une portion constante définissant cinq
classes principales: IgG, IgA, IgM, IgD et IgE. Toutes, en dépit de leur très
grande hétérogénéité, sont bâties sur un modèle de base commun et comportent 4
chaînes polypeptidiques groupées en deux paires identiques de taille inégale:
- Deux
chaînes lourdes identiques (H : heavy) : elles sont spécifiques pour
chaque classe d’Ig : cinq
isotypes (gamma, alpha, mu, delta et epsilon) définissent respectivement les 5 classes
d'Ig: IgG, IgA, IgM, IgD et IgE.
- Deux
chaînes légères identiques (L : light) Elles sont communes à l'ensemble des classes d'Ig, mais on en
distingue 2 types antigéniquement différents: le type kappa et le type lambda. Dans une molécule donnée d'Ig les deux
chaînes légères sont toujours du même type.
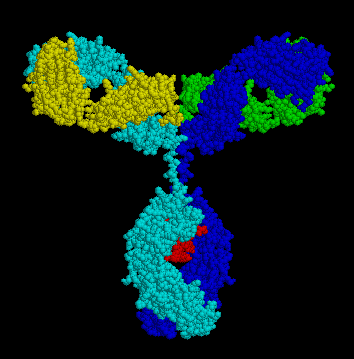
Les
molécules les plus simples (de formule moléculaire H2L2) visualisées au
microscope électronique se présentent sous la forme d’un «Y» dont les bras
peuvent s’ouvrir à 180°. Cette plasticité est assurée par une région dite «charnière».
Dans la molécule d’Ig, chaque chaîne «H» est unie à l’autre
et à une chaîne «L» par des liaisons covalentes de type pont disulfure (S-S)
intra- et inter-caténaires, et non covalentes: ioniques, hydrogènes,
électrostatiques, hydrophobes …etc. Sur le
squelette polypeptidique des immunoglobulines sont greffés des résidus
osidiques (glucosamine, acide sialique …).
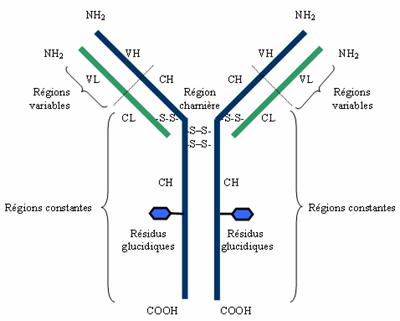
I – 2 – Dualités structurale et fonctionnelle :

Les
molécules d’immunoglobulines sont caractérisées par une dualité fonctionnelle
qui repose sur une dualité structurale:
- La
fonction de reconnaissance, exprimée
par la partie amino-terminale, est une région variable d’une immunoglobuline à l’autre, destinée à distinguer de
façon spécifique un nombre illimité d’antigènes différents.
- La
fonction effectrice, exprimée par la
partie carboxy-terminale relativement constante, est impliquée dans la
liaison de ces anticorps appelés cytophiles avec les différentes cellules du
système immunitaire (cellules mononucléées, neutrophiles, mastocytes,
basophiles, plaquettes et lymphocytes T et/ou B). La fonction effectrice est
aussi représentée par la fixation au complément (groupe de protéines sériques à
activité enzymatique qui interviennent dans les réactions inflammatoires en
association avec les IgM et les IgG sauf les IgG4).
I – 3 – Classes et sous classes des
immunoglobulines :

On
distingue chez les mammifères cinq classes d’immunoglobulines qui diffèrent par
leur poids moléculaire (PM), leur charge, leur composition en acides aminés et
en sucres et de ce fait par leurs fonctions (voir tableau ci-dessous).
(Réalisation du
tableau référencé : devoir à faire pour la séance de TD).
Tab. Propriétés et caractéristiques des 5 classes d’Ig
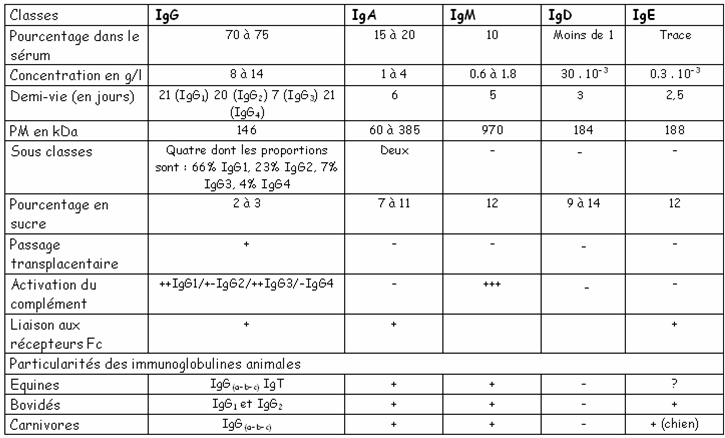
Les IgA: elles sont en général (plus de 80
%) monomériques mais peuvent exister simultanément dans le sérum sous des
formes polymères (di, tri, tétra ou même pentamères) reliées entre elles par la
chaîne J. Ces protéines reliées par une pièce sécrétoire sont majoritaires dans
les sécrétions séro-muqueuses telle que la salive, les sécrétions trachéo-bronchiques,
le colostrum, le lait et les sécrétions génito-urinaires.
Les IgM:
elles sont sous forme pentamérique dans le sérum et sont majoritaires parmi les
anticorps précoces dirigés contre les agents infectieux. Elles sont
synthétisées chez le fœtus dès la dixième semaine mais à un taux infime.
Les IgD: elles sont monomériques et ont un
rôle éventuel dans l’induction par l’antigène de la différenciation du
lymphocyte.
Les IgE: elles sont également monomériques et interviennent surtout dans les processus allergiques et l’immunité antiparasitaire contre les helminthes.

Le nombre de structures différentes que le
système immunitaire est appelé à reconnaître est extrêmement élevé. Pour la
réponse humorale on estime que la taille moyenne d'un clone est d'environ 103 cellules, ce qui fait que les 1011 lymphocytes B présents à un instant donné sont
capables de produire 108 molécules d'anticorps
différentes. Le problème qui se pose est de savoir comment le système
immunitaire peut générer une telle diversité, puisque le nombre total de gènes
chez l'homme se situe aux alentours de 5. 104 pour l'ensemble du génome.
I
– 4 - 1 – Aspects cytologiques :

Dans les LcB jeunes dits pré-B, on trouve en
immunofluorescence de l'IgM exclusivement dans le cytoplasme, ou plus
précisément des chaînes lourdes µ seulement, puis au fur et à mesure de la
maturation cellulaire les Ig s'expriment à la surface de la cellule (IgS)
ancrées dans la membrane, servant de récepteurs spécifiques d'antigènes (BcR).
Certains LcB à un moment donné de leur existence peuvent posséder simultanément
des IgS de plusieurs classes, c.-à-d. plusieurs isotypes : IgM, IgD,
quelquefois IgG. Il s'agit de cellules en train d'opérer la commutation, le
"Switch".
Mais il est important de noter que dans ces
cas la spécificité idiotypique, portée par les parties variables des chaînes
d'Ig, reste rigoureusement la même pour les diverses IgS d'un lymphocyte donné.
Par contre un clone de plasmocytes, provenant de la division et de la
différenciation d'un LcB activé, ne porte plus d'IgS mais sécrète activement un
grand nombre de molécules d'Ig toutes de même isotype, même allotype, même
idiotype.
I
- 4 – 2 – Aspects biochimiques :

La synthèse des Ig obéit aux règles générales de la synthèse
des protéines; on a pu isoler des ARN messagers de deux tailles différentes :
les uns codant pour les chaînes lourdes, les autres plus courts codant pour les
chaînes légères. Ces chaînes d'Ig transitent nécessairement par le corps de
Golgi où les glycosyl-transférases attachent en des points et selon une
séquence bien déterminée les groupements prosthétiques glucidiques. Les Ig
achevées quittent le plasmocyte par un processus de pinocytose inverse. En ce
qui concerne les Ig polymères (IgM, IgA sécrétoire) l'assemblage des
sous-unités se fait essentiellement à la phase finale, juste au moment du
franchissement de la membrane plasmique. La chaîne J, elle-même synthétisée par
le plasmocyte.

A partir de 1975 les spécialistes de la
biologie moléculaire, Tonegawa en
tête, se sont attachés à décrire l'organisation des gènes d'immunoglobulines
d'abord des souris puis de l'homme. Les gènes des différentes chaînes d’immunoglobulines
ont été localisés : sur le chromosome 14q32
pour les chaînes lourdes, sur le chromosome 2p12 pour les chaînes et sur le chromosome 22q11 pour les
chaînes.
L'étude comparative attentive, aidée d'ordinateurs
(bioinformatique), de nombreuses séquences disponibles de chaînes lourdes et
légères, révèle que les parties variables V sont nécessairement raccrochées à des
parties constantes C ; de même il existe un système indépendant
du précédent pour V et C. Par contre, les parties VH peuvent se trouver associées à n'importe
quelle partie constante de chaînes lourdes, c-à-d C , C, C, C, C (sans mentionner en réalité les
sous-classes correspondantes).

Il est donc particulièrement remarquable que les régions Vh sont communes et que l'individualisation
des classes provient exclusivement de la structure de la région constante de
leur chaîne lourde. Chaque domaine (VH, VL, C, C, C, etc...) est codé par un fragment génique.
Ces fragments sont éloignés et non transcrits dans l'ADN génomique. Uniquement
dans le lymphocyte B qui se différencie ces gènes vont être rapprochés
(réarrangés) pour être transcrits et formés un ARN messager primaire. Ce
processus semble d'ailleurs assez général pour diverses protéines et valable
également pour les chaînes du récepteur des LcT.
On
est ainsi arrivé à la conclusion que la diversité des anticorps reposait sur
des mécanismes de codant pour la quasi totalité N-terminale de la région V et des recombinaisons
génétiques entre fragments géniques. Il a été montré que l'obtention d'une
région variable complète nécessitait le rapprochement de deux fragments géniques pour les chaînes légères et de trois pour
les chaînes lourdes. En effet, pour
les deux types de chaînes, on décrit des gènes
Vgènes J (pour jonction) pour la dizaine
d'acides aminés C-terminaux de liaison avec le premier domaine constant.
Uniquement pour les chaînes lourdes existe un troisième type de fragment
génique, des gènes D (pour
diversité), codant pour quelques acides aminés, entre les produits des gènes V
et des gènes J.
Dans le lymphocyte B immature alors que les chaînes lourdes sont déjà apparues on assiste
à un phénomène de translocation c'est-à-dire à un rapprochement au hasard d'un
des gènes V de l'un des gènes J avec élimination de la
partie intermédiaire. Cet ensemble VJ-C sera transcrit en un ARN messager
primitif intra-nucléaire beaucoup plus long que l'ARN messager définitif
cytoplasmique. Entre les deux un processus d'épissage ("splicing")
aura rapproché VJ de C, cet ensemble sera finalement traduit au niveau du
polysome cytoplasmique en une chaîne légère finale (laquelle s'assemblera, on
l'a déjà dit, dans l'ergastoplasme à la chaîne lourde qui vient de naître pour
former l'immunoglobuline entière).
On distingue donc quatre étapes conduisant à la production de chaînes légères pour le
lymphocyte B. Dans l'ADN en configuration germinale (ou embryonnaire) une
recombinaison somatique rapproche un gène V d'un gène J avec excision de l'ADN
intercalaire. La deuxième étape de transcription conduit à un mARN primaire de
l'ensemble V-J-intron-C. La troisième étape d'épissage élimine l'intron et
aboutit à un mARN mature qui est finalement traduit en chaîne polypeptidique
par la quatrième étape.
Pour
les chaînes lourdes :
Comme on l'a déjà dit il n'existe qu'une
seule grande famille de gènes VH, tous
situés sur le chromosome 14 chez l'homme de même que les gènes commandant aux
diverses parties constantes. Mais la variabilité est ici accrue, apportée non
seulement par l'existence de gènes J
différents des précédents, mais encore par des petits segments génétiques
supplémentaires appelés D pour diversité. Tous ces groupements de gènes sont
éloignés les uns des autres dans l'ADN primitif génomique et se rapprochent
progressivement par des recombinaisons ou translocations successives pour être
finalement traduits en chaînes lourdes au niveau des lymphocytes B. C'est ainsi
que dans le lymphocyte pro-B s'opère le premier réarrangement des gènes des
chaînes lourdes, plus précisément de la chaîne lourde µ qu'on trouvera
synthétisée à l'intérieur du lymphocyte pré-B.
Il y a d'abord rapprochement, au hasard, d'un gène D et d'un gène J, puis l'un des gènes VH se rapproche de D formant ainsi un complexe VDJ qui reste au début éloigné des gènes des parties constantes C. Le rapprochement se fera au niveau de l'ARN messager primordial par un phénomène d'épissage comparable à celui décrit pour les chaînes légères et au niveau de l'ARN messager final opérationnel cytoplasmique on aura bien la séquence VDJC traduite en la chaîne lourde correspondante. Comparativement aux chaînes légères il existe donc une étape supplémentaire pour les chaînes lourdes puisqu'il existe deux réarrangements : d'abord D-J, puis V-DJ.


Enzymes
du réarrangement :
Ils sont le fait d'une recombinase (endonucléase et ligase) qui reconnaît des signaux
spécifiques en 5' et en 3' des gènes D, en 3' des gènes V et en 5' des gènes J.
L'ADN intermédiaire est éliminé par délétion sous forme de boucle d'excision,
qui sont dégradées : l'information génétique comprise entre les deux segments
géniques rapprochés par recombinaison est définitivement éliminée.
La
recombinase est une enzyme
contenant sans doute 2 protéines se liant à l'ADN l'une qui reconnaît la
première séquence signal avec son espaceur de 12 paires de base et l'autre la
seconde séquence signal avec l'espaceur de 23 paires de base. Deux gènes ont
ainsi été isolés et appelés RAG-1 et
RAG-2 (pour "recombinase activating gene"). D'autres protéines,
Ku70, Ku86 et une protéine kinase ADN-dépendante interviennent également dans
les mécanismes de recombinaison.
La
recombinase V(D)J n'est active que dans les lymphocytes B et T, ce que
traduit la spécificité d'expression tissulaire des gènes RAG-1 et RAG-2. Les
autres composants de la recombinase (exonucléase, ligase, polymérase...) sont
exprimés dans tous les tissus.
Mécanisme
du "Switch" :
Une fois obtenus, les réarrangements
fonctionnels d'une chaîne lourde (VDJ) et d'une chaîne légère (VJ), dont
l'association définit une spécificité anticorps, sont définitifs et caractérisent un clone
lymphocytaire. Cependant au niveau du locus IgCH, sur le chromosome 14, le
gène réarrangé VDJ a la possibilité de s'apparier avec différents gènes codant
pour les parties constantes.
Sur le chromosome 14, chez l'homme, à la
suite des gènes codant pour les parties variables on trouve une série de 11
gènes pour les parties constantes à savoir dans l'ordre de 5' vers 3' µ, , 3, 1, , 1, , 2, 4, , 2 (les gènes et sont des pseudogènes et ne sont pas
exprimés). Chaque gène est précédé d'une séquence dite "Switch" ou de commutation qui permet à l'ensemble VDJ de "s'accrocher"
à un gène C différent.
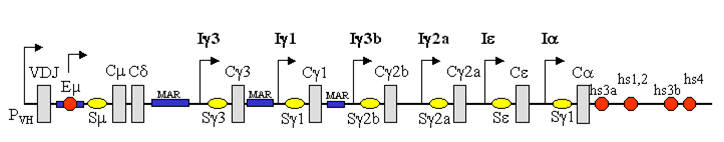
Les régions S sont composées de séquences
répétées en tandem du type (GAGCT)n. On comprend bien étant donné la place toute
initiale du gène Cµ la raison pour laquelle c'est précisément l'isotype IgM qui
s'exprime en tout premier. On constate qu'une telle séquence "switch"
n'existe pas en avant du gène C expliquant ainsi la présence très
fréquente simultanée d'IgM et d'IgD à la surface du même lymphocyte B au début
de sa carrière, avant qu'il ne soit déterminé en isotype définitif en fonction
de l'antigène et des signaux "helper" reçus des lymphocytes T.
Le lymphocyte B immature n'exprime qu'une
IgM membranaire. Ultérieurement la coexpression de l'IgM et de l'IgD définit le
lymphocyte B mûr naïf, qui représente 70 % des petits lymphocytes B sanguins.
Après stimulation par l'antigène, ces lymphocytes perdent l'expression de l'IgD
pour beaucoup, devenant, soit des plasmocytes sécréteurs d'IgM ou de rares
lymphocytes mémoire, soit pour une infime minorité perdent leur IgM et
deviennent des plasmocytes à IgD.
Après stimulation par l'antigène, le
lymphocyte B qui exprime une IgM de membrane peut se différencier en plasmocyte
sécréteur d'IgG, d'IgA ou d'IgE.
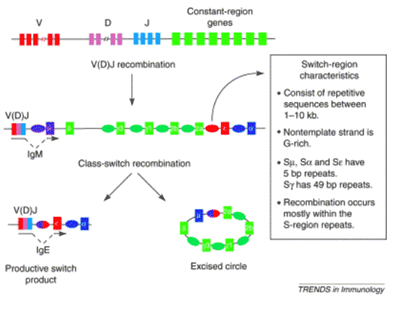
La preuve en est fournie par le très rare déficit de
l'immunité humorale avec hyper-IgM, qui se traduit par une absence d'IgG et
d'IgA contrastant avec un taux élevé d'IgM, secondaire à un défaut de
commutation consécutif à l'absence de CD40L fonctionnel sur le lymphocyte T.
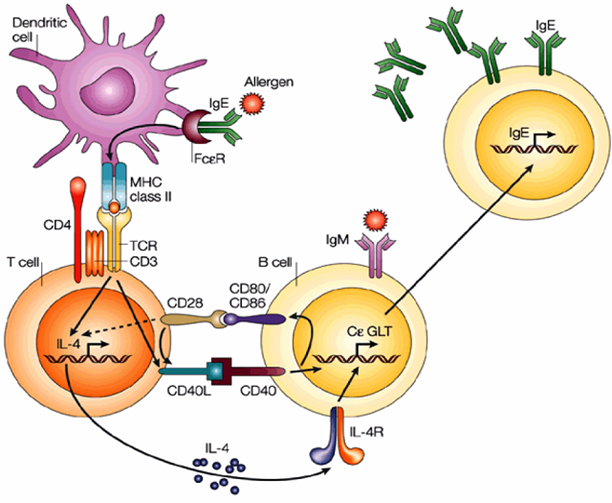
Raif S. Geha Nature Reviews Immunology
3, 721-732 (2003)

Les
immunoglobulines sont des glycoprotéines de haut poids moléculaire et de
structure complexe. Ce sont donc d’excellents antigènes; Et comme tout
antigène, ils possèdent des déterminants antigéniques répartis en trois
types :
-
Déterminants isotypiques : présents chez tous les individus d’une même
espèce. Ils correspondent aux motifs définissant les classes et sous-classes
des Ig, ainsi que les 2 types de chaînes légères.
-
Déterminants allotypiques : propres à un groupe d’individus au sein d’une
même espèce. Ils sont représentés par des marqueurs ponctuels situés sur les
parties constantes des Ig. Ils constituent des systèmes tels les marqueurs :
Km, Gm, A2m …
-
Déterminants idiotypiques : ce sont des spécificités individuelles de
chaque immunoglobuline reflétant la séquence et la conformation des régions
variables des chaînes lourdes et légères. Caractéristiques du site Ac, ils
confèrent une antigénicité à chaque fois différente.
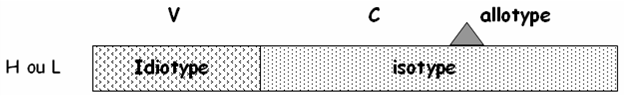
Les trois niveaux
d’hétérogénéité des immunoglobulines
I – 6 – Superfamille des immunoglobulines :

On sait aujourd’hui que certaines molécules membranaires, importantes pour le système immunitaire, possèdent une organisation analogue à celles des immunoglobulines, et des séquences semblables d’acides aminés. C’est le cas notamment des récepteurs des lymphocytes T « TcR » et d’un antigène commun aux cellules du cerveau et aux lymphocytes T , appelé antigène «Thy-1», ainsi que les protéines du CMH, de classe I et de classe II, la b2 microglobuline, le CD4, …etc.
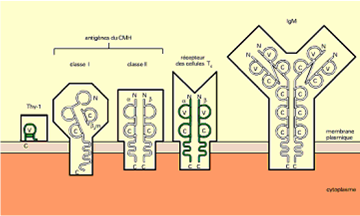
Schéma représentant quelques membres de la
superfamille des Ig
I – 7 - Dynamique de la réponse immunitaire à médiation
humorale : 
I
- 7 – 1 - Les mécanismes de la production des
immunoglobulines :

Les processus de la réponse humorale
sont différents selon qu’il s’agisse d’Ag thymodépendants (TD) ou
thymoindépendants (TI). Dans les deux cas, les LcB reconnaissent l’Ag intact
dans sa forme native par les immunoglobulines M (IgM) membranaires; cette
interaction précède les trois autres étapes de la réponse immunitaire:
l’activation, la prolifération et la différenciation du Lc B aboutissant à la
production d’anticorps (Ac). Lorsque l’antigène est TD, il est reconnu
séparément par les lymphocytes B et T helper (LcTh) qui doivent obligatoirement
coopérer pour parvenir à stimuler la prolifération et différenciation
lymphocytaires.
La majorité
des Ag induisent une reconnaissance mixte, à la fois par les cellules B et T :
Ce sont les Ag T dépendants. L’antigène est phagocyté par une cellule présentatrice d’Ag (CPAg), tel
un macrophage, qui après l’avoir internalisé et dégradé en partie, va
l’analyser et en extraire des peptides hautement antigéniques. Il va ensuite
les exprimer à la surface de sa membrane, associés aux antigènes CMH de classe
2. Il les présente ainsi aux LcTh, qui, de leur côté, possèdent un récepteur
spécifique de l’antigène en question et des produits de classe 2.
D’une part, cette reconnaissance, combinée à la
production d’IL-1 par le macrophage, va constituer un signal intercellulaire
d’activation ayant plusieurs effets : le LcTh va se mettre à produire de
l’IL-2, qui va créer une boucle autocrine de rétro-contrôle positif sur sa
propre production, ce qui va faciliter la reconnaissance de l’antigène, puis le
LcTh va se diviser en une cellule mémoire et une cellule effectrice, qui elles
mêmes vont se diviser…. C’est l’expansion clonale.
D’autre part, le LcTh (cellule effectrice) va par la
suite aller à la rencontre d’un LcB qui a reconnu l’antigène grâce à une Ig de
surface. Il va produire les facteurs helper (dont IL-2 fait partie) qui vont
activement participer à la prolifération clonale du LcB, avec apparition de
cellules filles « mémoire » et de cellules filles effectrices, qui
vont se différencier une ultime fois en plasmocytes et produire des Ig.

Ainsi, il
existe 2 signaux d’activation faisant intervenir des déterminants antigéniques
distincts :
* Le 1er
: résulte de la fixation d’un Ag sur le récepteur : Ig de mb des lymphocytes B.
* Le 2ème
: provient des cellules T helper, qui reconaissent l’Ag présenté par les CPA
associé aux produits classe I du CMH et par l’intermédiaire du récepteur à l’Ag
: TCR. Ces cellules T activées agissent soit en produisant des facteurs
solubles, soit par contact direct avec les lymphocytes B : dans ce cas ce sont
les L B qui présentent l’Ag aux T helper.
B – Pour les antigènes T-indépendants :
Il existe un
petit nombre d’Ag capables d’activer les Lc B sans l’aide des Lc T et sans
passer par les CPAg. Ces Ag T indépendants sont caractérisés essentiellement par
leurs déterminants antigéniques répétitifs (ils sont constitués de grosses
molécules polymérisées), et le fait qu’ils n’induisent pas de maturation de

Le système est
donc plus rapide : le LcB, avec ses Ig membranaires, va reconnaître les
déterminants antigéniques, ce qui va conduire à l’activation du LcB, et induire
sa prolifération et sa différenciation en plasmocyte producteur d’Ig.

A la
suite d’un premier contact antigénique, un organisme élabore une réponse
immunitaire primaire. Quand la mémoire immunitaire est établie, tout contact
ultérieur, avec le même antigène, produit une réponse secondaire. Cette mémoire
persiste en général très longtemps, plusieurs mois chez la souris et plusieurs
années chez l’Homme. La mémoire immunitaire repose sur l’expansion sélective
des clones spécifiques de l’antigène après la première stimulation.
Lors d’un premier contact avec un antigène donné, ce
sont les IgM qui apparaissent en premier, car elles sont plus efficaces et sont
capables d’activer le complément. On a donc une croissance exponentielle de la
production d’IgM, puis un plateau, puis une décroissance. Au bout de 14 jours
la quantité d’IgM circulantes est revenue à son niveau initial.
Lors d’un second contact avec le même antigène, ce
sont cette fois les IgG qui apparaissent les premiers, avec une augmentation
forte et rapide, puis elles maintiennent leur taux assez longtemps. Il y a donc
une augmentation accrue de la production d’IgG (à condition que l’antigène
présenté soit T dépendant) car il y a lors de la réponse secondaire, une
commutation de classe : production d’IgG plutôt que d’IgM, IgG à très
forte affinité vis-à-vis de l’antigène. Ceci reflète l’existence d’une mémoire
immunitaire.
A - Réponse humorale primaire (à la suite d’une première stimulation
antigénique) : La réponse primaire passe par trois phases:
- une phase de latence de plusieurs jours (dizaines) pendant laquelle aucun anticorps n’est décelable;
- une phase de croissance où la concentration sérique
des anticorps spécifiques (essentiellement des IgM) augmente de façon
exponentielle (logarithmique)
- une phase dite en plateau où, comme son nom l’indique,
les anticorps sériques restent en quantité à peu près constante;
- une phase de décroissance où la concentration
sérique en anticorps décroît plus ou moins rapidement en fonction de leur
dégradation naturelle (catabolisme) ou de leur fixation sur l’antigène.
NB : On peut avoir de faibles
quantités d’IgG produites à la fin de cette période.
B - Réponse humorale secondaire : Par rapport à la
réponse primaire, la réponse secondaire présente:
- Une période de
latence plus courte;
- Des niveaux
maximaux d’anticorps nettement plus élevés (10 fois plus);
- Une phase en
plateau plus prolongée et une période de décroissance plus lente;
- Une proportion
nettement plus grande en anticorps de classe IgG qu’IgM (Ag TD);
- Une affinité plus
élevée des anticorps (augmentation
de l’affinité = intensité des forces de liaison).


Voir CV






